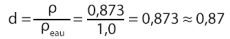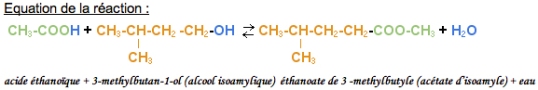Les arômes
Le parfum d’un bonbon est dû à une aromatisation qui dote les produits de confiserie de caractéristiques olfactives et gustatives qui leurs sont propres. Dans l’alimentation, les arômes sont utilisés comme additifs afin d’attribuer aux aliments un goût plaisant, qui stimule fortement l’appétit. Ils sont donc des ingrédients indispensables dans la fabrication des bonbons. En revanche leur intérêt nutritionnel est plus que limité : il ne possèdent aucune qualité nutritive !
Cette aromatisation peut être réalisée avec des arômes naturels, c’est à dire des arômes présents dans la nature, comme l’eugénol, présent dans le clou de girofle, comme la cannelle, issue de la moulure de l’écorce du cannelier, ou encore la vanilline, une espèce chimique aromatique présente naturellement dans la gousse de vanille. Cependant, seulement 25 grammes de vanilline sont présents dans un kilo de gousses de vanille. Cela illustre la rareté de certains de ces arômes, qui sont par conséquent très chers. (La vanilline extraite des gousses de vanille, revient à plus de 300€ le kilogramme contre 15€ si on la synthétise.)
C’est pourquoi, des arômes sont synthétisés pour la fabrication des bonbons.
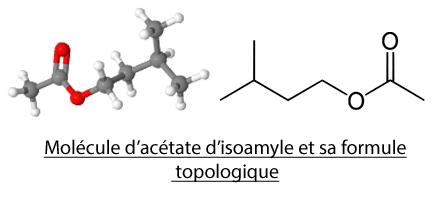
Les arômes dits “identiques” sont des espèces chimiques synthétisées mais qui existent dans la nature. Par exemple l’acétate d’isoamyle donne un parfum de banane, et le menthol donne un goût de menthe poivrée.
D’autres dits “artificiels”, n’existant pas dans la nature, sont également synthétisés. C’est le cas de l’éthyl-maltol qui donne un léger goût de caramel et de sucre cuit, comme la barbe-à-papa, et qui possède un pouvoir aromatique environ 6 fois supérieur à son équivalent naturel, le maltol.

La première de ces espèces chimiques est naturelle tandis que la seconde est artificielle. Toutefois, on remarque qu’elle sont chimiquement très proches.
Nous allons nous intéresser à la synthèse d’un ester: l’arôme de banane.
Nous disposions du matériel et des réactifs suivant:

- montage de chauffage à reflux,
- ampoule à décanter,
- cristallisoir,
- ballon,
- pierre ponce,
- béchers,
- eau salée glacée,
- hydrogénocarbonate de sodium à 5%,
- alcool isoamylique,
- acide acétique,
- acide sulfurique,
- eau.

Tout d’abord, nous avons introduit dans un ballon 15mL d’alcool isoamylique, 20mL d’acide acétique, 1mL d’acide sulfurique et quelques grains de pierre ponce.
Puis nous avons porté à ébullition douce pendant 20 minutes à l’aide du chauffage à reflux.

Nous avons laissé refroidir le mélange à température ambiante …

… avant de l’introduire dans l’ampoule à décanter et d’y ajouter 10mL d’eau salée, dans le but de séparer la phase organique de la phase aqueuse.

Ensuite nous avons ajouté 30mL d’eau salée ainsi que 15mL d’hydrogénocarbonate de sodium dans l’ampoule à décanter contenant la phase organique récupérée afin d’éliminer l’acide qu’il pourrait rester avant de séparer de nouveau les deux phases.

Enfin, nous avons ajouté quelques cuillères de sulfate de magnésium anhydre à la phase organique pour sécher, c’est à dire éliminer les éventuelles traces d’eau, puis nous l’avons filtrée et nous avons récupéré l’ester.
L’arôme récupéré avait une très forte odeur de banane, voire d’arlequin !
Bilan de la synthèse :
L’estérification de l’alcool isoamylique par l’acide éthanoïque est une réaction lente, équilibrée.
On sait que la densité de l’acétate d’isoamyle s’élève à 0,87. Comparons-la maintenant à celle de l’ester synthétisé :
Le volume d’acétate d’isoamyle récupéré était de 13,5 mL, sa masse de 11,78g.
D’où sa masse volumique :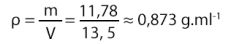
Cela est en accord avec la densité théorique de l’acétate d’isoamyle.